Quando, prima, durante o dopo una discussione in proposito, sorge, inevitabile e ineludibile, la fatidica domanda “Cosa è la qualità?” mi vengono in mente sia la risposta di Sant’Agostino "Se nessuno me lo domanda, lo so. Se voglio spiegarlo a chi me lo domanda, non lo so più." [a] sia la risposta di Bruno de Finetti “...ma davvero “esiste”... ? E cosa mai sarebbe? Io risponderei di no, che non esiste...” [b]. So che potrebbero sembrare delle pessime premesse. Ma è a partire da queste domande, intese come uno spunto alla riflessione, che vorrei cercare di affrontare il discorso sulla qualità, che nella Medicina di Laboratorio si sviluppa su piani diversi. Qui io convenzionalmente ne identifico quattro:→ qualità tecnica del processo analitico;→ qualità del contenuto scientifico;→ qualità del processo di comunicazione;→ sistema di gestione per la qualità. L’obiettivo è di dare maggior respiro al tema della qualità. Che sembrerebbe ormai un po’ trito, ma che invece, visto con i giusti occhi [c], può riservare ancora numerose e interessanti scoperte. Ma dato che l’argomento è complesso, è necessario prima fare chiarezza partendo dalla terminologia, troppo spesso utilizzata in modo approssimativo o improprio, trattandosi di argomento di moda. Cosa che farò correndo il rischio di essere pedante, ma ricordando a quanti mi riterranno tale che senza la pedanteria nella definizione (tanto per fare un esempio) di cosa sia una molecola di glucosio, oggi non saremmo in grado di assicurare ai pazienti una semplice glicemia (anzi, sempre per essere pedanti, una semplice “misura della concentrazione del glucosio nel plasma”). Il sistema nazionale per l’accreditamento (fino al 21 dicembre 2009) In Italia operavano fino al 21 dicembre 2009 tre Enti di accreditamento in ambiti differenti:→ il SINCERT, ovvero Sistema Nazionale per l’Accreditamento degli Organi di Certificazione e Ispezione, che accreditava gli Organismi di certificazione e ispezione;→ il SINAL, ovvero Sistema Nazionale per l’Accreditamento dei Laboratori, che accreditava i laboratori di prova;→ il SIT, ovvero Servizio di Taratura in Italia, che accreditava i laboratori di taratura. I tre soggetti si erano associati nel 2004 nella Federazione degli Enti di Accreditamento (FIDEA) che, come previsto dalla legislazione comunitaria, entro il gennaio del 2010 doveva essere sostituita da un Ente Unico di Accreditamento. Mentre SINAL e SIT accreditavano direttamente i laboratori, il compito del SINCERT era quello di accreditare gli Organismi di Certificazione e Ispezione, con lo scopo di accertarne la competenza e di garantire il valore e la credibilità delle Certificazioni di conformità ad una determinata norma (come ad esempio la UNI EN ISO 9001:2008) da essi rilasciate. Un compito di accreditamento/controllo strategico, in quanto il venire meno al rispetto delle regole e dell’etica professionale da parte degli Organismi di Certificazione e Ispezione farebbe crollare l’intero sistema della certificazione. Il sistema nazionale per l’accreditamento (a partire dal 22 dicembre 2009) Dal 22 dicembre 2009 ACCREDIA (http://www.accredia.it) è l'Ente unico nazionale riconosciuto e autorizzato dallo Stato per svolgere l'attività di accreditamento. ACCREDIA nasce dalla fusione di SINCERT e SINAL. Il SIT (Servizio di Taratura in Italia) è diventato ora il “Dipartimento laboratori di taratura” di ACCREDIA. Certificazione e Accreditamento I produttori/fornitori di beni/servizi si possono rivolgere a uno dei tanti Organismi di Certificazione e Ispezione accreditati da ACCREDIA per una procedura di certificazione, che può riguardare un Sistema di Gestione (certificazione di sistema) o uno specifico prodotto (certificazione di prodotto). Si rivolgono invece direttamente ad ACCREDIA per una procedura di accreditamento, sulla quale ACCREDIA svolge successivamente la sua attività di vigilanza, che garantisce il mantenimento nel tempo dei requisiti previsti:→ coloro che intendono svolgere attività come Organismi di Certificazione e Ispezione;→ i Laboratori di prova;→ i Laboratori di taratura. Il raccordo logico/funzionale tra l’accreditamento, la certificazione e alcune Norme che hanno un impatto in sanità e sui laboratori di analisi cliniche/mediche, è illustrato nel seguente schema. 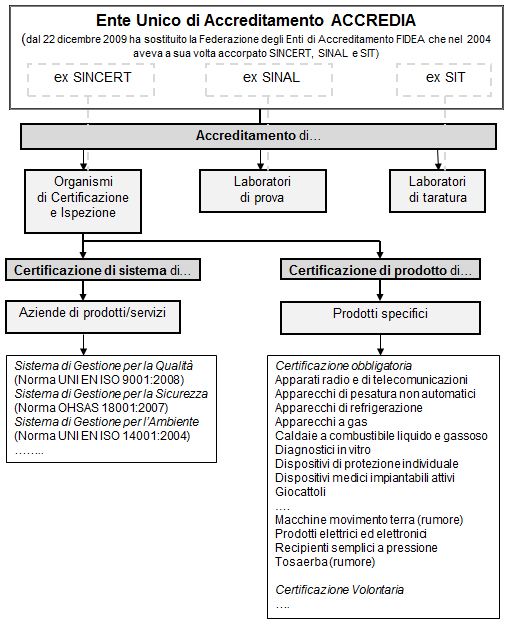 Certificazione La certificazione è una procedura con la quale una parte terza dà assicurazione scritta che un sistema di gestione o un prodotto è conforme ai requisiti specificati in una norma. L’organismo di Certificazione e Ispezione che rilascia una certificazione di un sistema di gestione opera in accordo ai requisiti della norma UNI CEI EN ISO/IEC 17021:2006 “Valutazione della conformità - Requisiti per gli organismi che forniscono audit e certificazione di sistemi di gestione”. Esempi di sistemi di gestione certificabili sono:→ il sistema di gestione aziendale per la qualità, che può essere certificato secondo la norma UNI EN ISO 9001:2008;→ il sistema di gestione aziendale per la salute e sicurezza sui luoghi di lavoro, che può essere certificato secondo la norma OHSAS 18001:2007 (dove OHSAS è l’acronimo di Occupational Health and Safety Assessment Series);→ il sistema di gestione aziendale per l’ambiente, che può essere certificato secondo la norma UNI EN ISO 14001:2004;→ il sistema di gestione per la sicurezza alimentare, che può essere certificato secondo la norma ISO 22000:2005. L’organismo di Certificazione e Ispezione che rilascia una certificazione di prodotto opera in accordo ai requisiti della norma UNI CEI EN 45011:1999 “Requisiti generali relativi agli organismi che gestiscono sistemi di certificazione di prodotti”. Vi sono due tipi di certificazione di prodotto:→ la certificazione volontaria, che ha l’obiettivo di rendere riconoscibili sul mercato le caratteristiche dei prodotti fornendo riferimenti precisi e identificabili al consumatore, e quindi rappresenta un efficace strumento di promozione sul mercato;→ la certificazione obbligatoria, come ad esempio quella prevista dal DL 8 settembre 2002, n. 332 “Attuazione della direttiva 98/79/CE relativa ai dispositivi medico-diagnostici in vitro”, pubblicata sulla Gazzetta Ufficiale n. 269 del 17 novembre 2000, S.O. n. 189, che prevede il rispetto di requisiti specifici e quindi la marchiatura CE per i prodotti diagnostici del laboratorio di analisi cliniche. La certificazione obbligatoria ha lo scopo di (i) garantire i requisiti essenziali del prodotto a tutela della salute e della sicurezza delle persone durante il suo utilizzo, (ii) tutelare i produttori europei dalla concorrenza sleale da parte di produttori di altre aree geografiche che non si adeguano alle prescrizioni applicabili al prodotto specifico, e (iii) consentire la libera circolazione del prodotto nella dimensione comunitaria superando così le barriere di tipo tecnico e normativo dei diversi paesi della Unione Europea (UE). Accreditamento L’accreditamento è la procedura con la quale un organismo autorevole conferisce il riconoscimento formale che un organismo o una persona è competente ad eseguire specifici compiti. L’organismo (di parte terza) che rilascia un accreditamento opera in accordo ai requisiti della norma UNI CEI EN ISO/IEC 17011:2005 “Valutazione della conformità - Requisiti generali per gli organismi di accreditamento che accreditano organismi di valutazione della conformità” Nell’ambito dell’accreditamento sono previsti:→ l’accreditamento degli organismi di certificazione e ispezione, che a loro volta svolgono attività di certificazione di sistema e di certificazione di prodotto (vedi sopra);→ l'accreditamento dei laboratori di prova che risultano conformi ai requisiti della UNI CEI EN ISO/IEC 17025:2005 "Requisiti generali per la competenza dei laboratori di prova e taratura.". L’accreditamento dimostra la competenza tecnica del laboratorio ad effettuare le prove dallo stesso indicate, e conferma l’attuazione di un sistema gestionale per la qualità allineato ai principi della ISO 9001:2008. Per le prove indicate viene verificata la conformità ai requisiti tecnici previsti;→ l’accreditamento dei laboratori di taratura, sui quali si appoggia il sistema metrologico nazionale. Una nota aggiuntiva per la norma ISO 15189:2007 “Medical laboratories - Particular requirements for quality and competence”, che recita testualmente “This International Standard is not intended to be used for the purposes of certification” e ancora recita “This second edition cancels and replaces the first edition (ISO 15189:2003) which has been technically revised in order to align it more closely with the second edition of ISO/IEC 17025”. Tre fatti, cioè che la ISO 15189 non è certificabile, che la nuova versione è stata allineata alla ISO/IEC 17025, e gli stessi titoli delle due norme (ISO/IEC 17025 “Requisiti generali per la competenza dei laboratori...” e ISO 15189 “Laboratori medici - Requisiti particolari ... per la competenza”) indicano in modo evidente che la ISO 15189 appartiene al mondo dell’accreditamento, ed è strettamente collegata alla ISO/IEC 17025. Di fatto per un laboratorio di analisi cliniche adottare la ISO 15189 significa rientrare della stessa logica di accreditamento dei laboratori di prova, e accreditare la propria competenza nell’esecuzione delle singole specifiche prove (analisi di laboratorio). Quale sia il valore aggiunto dell’accreditamento ISO 15189 rispetto alla certificazione ISO 9001 nei casi in cui le prove (analisi di laboratorio) sono già normate dalla direttiva sulla diagnostica in vitro con marchiatura CE dei diagnostici è argomento di discussione. Sicuramente ci può essere un valore aggiunto nelle aree nelle quali il laboratorio voglia o debba mettere a punto test specifici (un esempio tipico è il cariotipo, per il quale non esistono diagnostici e nel quale i preparati cromosomici devono essere realizzati per intero manualmente rispettando condizioni operative rigorosissime). Regolamentazione governativa delle attività sanitarie Il quadro sopra descritto sarebbe tutto sommato abbastanza logico e lineare se non si aggiungessero le esigenze di regolamentazione delle attività sanitarie da o per conto del Governo: oggi, sostanzialmente, sono le Regioni a farlo. Queste istituzioni, oltre ad esercitare attività di controllo, richiedono ai soggetti che intendono esercitare attività sanitarie dei requisiti obbligatori, che portano all’autorizzazione e all’accreditamento. Possono essere distinti in questo senso diversi livelli, che possono differire nelle varie Regioni:→ l’autorizzazione della struttura, necessaria per realizzare una struttura sanitaria;→ l’autorizzazione dell’attività, necessaria per lo svolgimento di una attività sanitaria;→ l’accreditamento istituzionale, che consente di erogare prestazioni di ricovero e ambulatoriali in regime privatistico (l’attributo “istituzionale” è necessario per evitare i problemi di ambiguità derivanti dall’utilizzo dell’espressione “accreditamento” in differenti contesti);→ la messa a contratto, che consente di erogare, sulla base di uno specifico contratto con la Regione, che prevede tetti di spesa predefiniti e non superabili, prestazioni di ricovero e ambulatoriali riconosciute e rimborsate dal Servizio Sanitario Nazionale. Per un esempio pratico di norme che regolano l’autorizzazione e l’accreditamento in Sanità, si rimanda al sito della Regione Lombardia, Direzione Generale Sanità, all’indirizzo http://www.sanita.regione.lombardia.it/ alla voce Qualità e Controllo. Mondo sanitario e accreditamento A complicare ulteriormente la nozione di accreditamento vi sono altri tipi di accreditamento, tutti tesi a documentare che un organismo o una persona è competente ad eseguire specifici compiti, e basati sulla triade:→ accreditamento all’eccellenza;→ accreditamento di tipo volontario;→ accreditamento promosso dall’interno del mondo sanitario.Fanno parte di questo tipo di accreditamento, tra gli altri:→ il modello di accreditamento JCAHO (Joint Commission on Accreditation of Healthcare Organizations, http://www.jointcommission.org/), il sistema di accreditamento statunitense. Si fa notare che attualmente la Regione Lombardia sta sperimentando un processo di implementazione graduale dei requisiti JCAHO presso alcuni dei suoi Ospedali;→ il modello di accreditamento CPA (Clinical Patology Accreditation, http://www.cpa-uk.co.uk/) che prende spunto dal precedente e accredita i servizi di patologia clinica nel Regno Unito;→ l’accreditamento professionale, proposto in Italia da varie Società Scientifiche. Ha un carattere fortemente partecipativo, si propone come una attività di autoregolamentazione, e prevede un meccanismo di valutazione esterna tra pari (peer review) teso ad accertare il grado di corrispondenza a una serie di indicatori di qualità ampiamente condivisi. Il problema cruciale per l’accreditamento professionale, il problema che oncor oggi ne limita l’operatività e l’applicabilità, è rappresentato dalla capacità di fornire una garanzia di assoluta neutralità e indipendenza nel giudizio:→ chi può effettuare la valutazione (della competenza di un laboratorio)? → come si assicura la assenza di conflitti di interesse (nella valutazione della competenza di un laboratorio)?→ come si può garantire che un ispettore che è dipendente di un laboratorio pubblico sia oggettivo nelle conclusioni della sua ispezione ad un laboratorio privato?→ come si può garantire che un ispettore che è dipendente di un laboratorio privato sia oggettivo nelle conclusioni della sua ispezione ad un laboratorio pubblico?→ come si può garantire che un ispettore che è collega ed amico di un altro lavoratore che opera in un laboratorio pubblico sia oggettivo nelle conclusioni della sua ispezione all’amico e collega?→ come si può garantire che un ispettore che è collega ed amico di un altro lavoratore che opera in un laboratorio privato sia oggettivo nelle conclusioni della sua ispezione all’amico e collega? Delle implicazioni di questi tipi di approccio discuterò successivamente. Cerco ora di riassumere il tutto in un quadro sinottico, nel quale nell’ultima colonna sulla destra la sigla “na” indica che si tratta di requisito non applicabile ai laboratori di analisi cliniche/mediche, mentre la sigla “A” indica che si tratta di un requisito Applicabile ai laboratori di analisi cliniche/mediche.
Certificazione La certificazione è una procedura con la quale una parte terza dà assicurazione scritta che un sistema di gestione o un prodotto è conforme ai requisiti specificati in una norma. L’organismo di Certificazione e Ispezione che rilascia una certificazione di un sistema di gestione opera in accordo ai requisiti della norma UNI CEI EN ISO/IEC 17021:2006 “Valutazione della conformità - Requisiti per gli organismi che forniscono audit e certificazione di sistemi di gestione”. Esempi di sistemi di gestione certificabili sono:→ il sistema di gestione aziendale per la qualità, che può essere certificato secondo la norma UNI EN ISO 9001:2008;→ il sistema di gestione aziendale per la salute e sicurezza sui luoghi di lavoro, che può essere certificato secondo la norma OHSAS 18001:2007 (dove OHSAS è l’acronimo di Occupational Health and Safety Assessment Series);→ il sistema di gestione aziendale per l’ambiente, che può essere certificato secondo la norma UNI EN ISO 14001:2004;→ il sistema di gestione per la sicurezza alimentare, che può essere certificato secondo la norma ISO 22000:2005. L’organismo di Certificazione e Ispezione che rilascia una certificazione di prodotto opera in accordo ai requisiti della norma UNI CEI EN 45011:1999 “Requisiti generali relativi agli organismi che gestiscono sistemi di certificazione di prodotti”. Vi sono due tipi di certificazione di prodotto:→ la certificazione volontaria, che ha l’obiettivo di rendere riconoscibili sul mercato le caratteristiche dei prodotti fornendo riferimenti precisi e identificabili al consumatore, e quindi rappresenta un efficace strumento di promozione sul mercato;→ la certificazione obbligatoria, come ad esempio quella prevista dal DL 8 settembre 2002, n. 332 “Attuazione della direttiva 98/79/CE relativa ai dispositivi medico-diagnostici in vitro”, pubblicata sulla Gazzetta Ufficiale n. 269 del 17 novembre 2000, S.O. n. 189, che prevede il rispetto di requisiti specifici e quindi la marchiatura CE per i prodotti diagnostici del laboratorio di analisi cliniche. La certificazione obbligatoria ha lo scopo di (i) garantire i requisiti essenziali del prodotto a tutela della salute e della sicurezza delle persone durante il suo utilizzo, (ii) tutelare i produttori europei dalla concorrenza sleale da parte di produttori di altre aree geografiche che non si adeguano alle prescrizioni applicabili al prodotto specifico, e (iii) consentire la libera circolazione del prodotto nella dimensione comunitaria superando così le barriere di tipo tecnico e normativo dei diversi paesi della Unione Europea (UE). Accreditamento L’accreditamento è la procedura con la quale un organismo autorevole conferisce il riconoscimento formale che un organismo o una persona è competente ad eseguire specifici compiti. L’organismo (di parte terza) che rilascia un accreditamento opera in accordo ai requisiti della norma UNI CEI EN ISO/IEC 17011:2005 “Valutazione della conformità - Requisiti generali per gli organismi di accreditamento che accreditano organismi di valutazione della conformità” Nell’ambito dell’accreditamento sono previsti:→ l’accreditamento degli organismi di certificazione e ispezione, che a loro volta svolgono attività di certificazione di sistema e di certificazione di prodotto (vedi sopra);→ l'accreditamento dei laboratori di prova che risultano conformi ai requisiti della UNI CEI EN ISO/IEC 17025:2005 "Requisiti generali per la competenza dei laboratori di prova e taratura.". L’accreditamento dimostra la competenza tecnica del laboratorio ad effettuare le prove dallo stesso indicate, e conferma l’attuazione di un sistema gestionale per la qualità allineato ai principi della ISO 9001:2008. Per le prove indicate viene verificata la conformità ai requisiti tecnici previsti;→ l’accreditamento dei laboratori di taratura, sui quali si appoggia il sistema metrologico nazionale. Una nota aggiuntiva per la norma ISO 15189:2007 “Medical laboratories - Particular requirements for quality and competence”, che recita testualmente “This International Standard is not intended to be used for the purposes of certification” e ancora recita “This second edition cancels and replaces the first edition (ISO 15189:2003) which has been technically revised in order to align it more closely with the second edition of ISO/IEC 17025”. Tre fatti, cioè che la ISO 15189 non è certificabile, che la nuova versione è stata allineata alla ISO/IEC 17025, e gli stessi titoli delle due norme (ISO/IEC 17025 “Requisiti generali per la competenza dei laboratori...” e ISO 15189 “Laboratori medici - Requisiti particolari ... per la competenza”) indicano in modo evidente che la ISO 15189 appartiene al mondo dell’accreditamento, ed è strettamente collegata alla ISO/IEC 17025. Di fatto per un laboratorio di analisi cliniche adottare la ISO 15189 significa rientrare della stessa logica di accreditamento dei laboratori di prova, e accreditare la propria competenza nell’esecuzione delle singole specifiche prove (analisi di laboratorio). Quale sia il valore aggiunto dell’accreditamento ISO 15189 rispetto alla certificazione ISO 9001 nei casi in cui le prove (analisi di laboratorio) sono già normate dalla direttiva sulla diagnostica in vitro con marchiatura CE dei diagnostici è argomento di discussione. Sicuramente ci può essere un valore aggiunto nelle aree nelle quali il laboratorio voglia o debba mettere a punto test specifici (un esempio tipico è il cariotipo, per il quale non esistono diagnostici e nel quale i preparati cromosomici devono essere realizzati per intero manualmente rispettando condizioni operative rigorosissime). Regolamentazione governativa delle attività sanitarie Il quadro sopra descritto sarebbe tutto sommato abbastanza logico e lineare se non si aggiungessero le esigenze di regolamentazione delle attività sanitarie da o per conto del Governo: oggi, sostanzialmente, sono le Regioni a farlo. Queste istituzioni, oltre ad esercitare attività di controllo, richiedono ai soggetti che intendono esercitare attività sanitarie dei requisiti obbligatori, che portano all’autorizzazione e all’accreditamento. Possono essere distinti in questo senso diversi livelli, che possono differire nelle varie Regioni:→ l’autorizzazione della struttura, necessaria per realizzare una struttura sanitaria;→ l’autorizzazione dell’attività, necessaria per lo svolgimento di una attività sanitaria;→ l’accreditamento istituzionale, che consente di erogare prestazioni di ricovero e ambulatoriali in regime privatistico (l’attributo “istituzionale” è necessario per evitare i problemi di ambiguità derivanti dall’utilizzo dell’espressione “accreditamento” in differenti contesti);→ la messa a contratto, che consente di erogare, sulla base di uno specifico contratto con la Regione, che prevede tetti di spesa predefiniti e non superabili, prestazioni di ricovero e ambulatoriali riconosciute e rimborsate dal Servizio Sanitario Nazionale. Per un esempio pratico di norme che regolano l’autorizzazione e l’accreditamento in Sanità, si rimanda al sito della Regione Lombardia, Direzione Generale Sanità, all’indirizzo http://www.sanita.regione.lombardia.it/ alla voce Qualità e Controllo. Mondo sanitario e accreditamento A complicare ulteriormente la nozione di accreditamento vi sono altri tipi di accreditamento, tutti tesi a documentare che un organismo o una persona è competente ad eseguire specifici compiti, e basati sulla triade:→ accreditamento all’eccellenza;→ accreditamento di tipo volontario;→ accreditamento promosso dall’interno del mondo sanitario.Fanno parte di questo tipo di accreditamento, tra gli altri:→ il modello di accreditamento JCAHO (Joint Commission on Accreditation of Healthcare Organizations, http://www.jointcommission.org/), il sistema di accreditamento statunitense. Si fa notare che attualmente la Regione Lombardia sta sperimentando un processo di implementazione graduale dei requisiti JCAHO presso alcuni dei suoi Ospedali;→ il modello di accreditamento CPA (Clinical Patology Accreditation, http://www.cpa-uk.co.uk/) che prende spunto dal precedente e accredita i servizi di patologia clinica nel Regno Unito;→ l’accreditamento professionale, proposto in Italia da varie Società Scientifiche. Ha un carattere fortemente partecipativo, si propone come una attività di autoregolamentazione, e prevede un meccanismo di valutazione esterna tra pari (peer review) teso ad accertare il grado di corrispondenza a una serie di indicatori di qualità ampiamente condivisi. Il problema cruciale per l’accreditamento professionale, il problema che oncor oggi ne limita l’operatività e l’applicabilità, è rappresentato dalla capacità di fornire una garanzia di assoluta neutralità e indipendenza nel giudizio:→ chi può effettuare la valutazione (della competenza di un laboratorio)? → come si assicura la assenza di conflitti di interesse (nella valutazione della competenza di un laboratorio)?→ come si può garantire che un ispettore che è dipendente di un laboratorio pubblico sia oggettivo nelle conclusioni della sua ispezione ad un laboratorio privato?→ come si può garantire che un ispettore che è dipendente di un laboratorio privato sia oggettivo nelle conclusioni della sua ispezione ad un laboratorio pubblico?→ come si può garantire che un ispettore che è collega ed amico di un altro lavoratore che opera in un laboratorio pubblico sia oggettivo nelle conclusioni della sua ispezione all’amico e collega?→ come si può garantire che un ispettore che è collega ed amico di un altro lavoratore che opera in un laboratorio privato sia oggettivo nelle conclusioni della sua ispezione all’amico e collega? Delle implicazioni di questi tipi di approccio discuterò successivamente. Cerco ora di riassumere il tutto in un quadro sinottico, nel quale nell’ultima colonna sulla destra la sigla “na” indica che si tratta di requisito non applicabile ai laboratori di analisi cliniche/mediche, mentre la sigla “A” indica che si tratta di un requisito Applicabile ai laboratori di analisi cliniche/mediche.
Sistema di Gestione per la Qualità  I principi base o, se volete, le componenti elementari, i denominatori comuni delle tecniche volte ad assicurare la qualità di un prodotto o servizio, sono semplici, quasi ovvi:→ non dare mai niente per scontato;→ scrivere quello che si fa;→ fare quello che è scritto;→ documentare quello che accade.Eppure il cammino per arrivare alla attuale concezione della qualità è stato lungo e complesso. L'evoluzione della cultura della qualità ha attraversato tre fasi storiche: quella del Controllo di Qualità, quella della Assicurazione della Qualità e della Qualità Totale, e quella del Sistema di Gestione per la Qualità. Controllo di Qualità Negli anni '20 del secolo scorso Walter A. Shewhart, che allora lavora per i Bell Laboratories, crea le carte di controllo e il controllo statistico di qualità. Quando un punto cade al di fuori dei limiti stabiliti per una determinata carta i controllo, i responsabili del processo devono verificare se questo può essere stato determinato da una causa specifica, piuttosto che dalle normali deviazioni attese in base alla distribuzione dell'errore. Shewhart stabilisce i limiti 3-sigma (3 volte la deviazione standard) sulla base del fatto che:→ data una qualsiasi distribuzione di probabilità la probabilità di un risultato che si discosta dalla media di oltre k deviazioni standard è inferiore a 1/k2 (diseguaglianza di Chebyshev);→ per una distribuzione gaussiana almeno il 99% delle osservazioni sono contenute all'interno delle 3 deviazioni standard dalla media (intervallo compreso tra media - 2 DS e media + 2 DS). Il metodo "6-sigma" (six-sigma) viene introdotto successivamente, e per la prima volta dalla Motorola, nella seconda metà degli anni 80 da Bob Galvin e Bill Smith, e si diffonde rapidamente nell'industria americana. L'obiettivo della metodologia è di raggiungere un tale controllo del processo da avere soltanto 3,4 parti difettose per milione, il che porta a limiti molto restrittivi sulla variabilità del processo produttivo. La metodologia 6-sigma mira all’eliminazione dei difetti e degli sprechi piuttosto che al semplice miglioramento della prestazione media. Questo garantisce un impatto diretto sul cliente, inteso come fruitore del processo o prodotto. Dal Controllo di Qualità siamo arrivati alla soddisfazione totale del cliente (Total Customer Satisfaction) e quindi alla Assicurazione della qualità. Assicurazione della Qualità e Qualità Totale Il metodo statistico diventa solamente uno strumento all'interno di una filosofia della qualità più generalizzata, tesa ad assicurare la qualità del prodotto, e basata sul ciclo descritto da W. Edwards Deming, che introduce nell'industria giapponese i concetti di gestione che porteranno il Giappone ai vertici della produzione industriale nel mondo. Il ciclo consiste di quattro passi, Plan, Do, Check, Act, noti con l'acronimo PDCA. I quattro passi per assicurare la qualità all'interno del modello consistono rispettivamente in:→ Plan: stabilire gli obiettivi e sviluppare i processi necessari per assicurare i risultati desiderati;→ Do: implementare i processi sviluppati;→ Check: monitorare i processi implementati e valutarli confrontandi il risultati con gli obiettivi prestabiliti;→ Act: applicare le azioni necessarie per migliorare se il risultati evidenziano la necessità di un cambiamento/miglioramento. Contemporaneo di Deming, Joseph M. Juran è un altro dei pionieri nell’ambito della Qualità Totale e, con i suoi settant’anni di carriera, si può considerare a pieno titolo uno dei “padri” della qualità. I tempi sono maturi per il terzo passo, quello della Gestione per la Qualità. Sistema di Gestione per la Qualità L'ultimo quarto del XX secolo vede svilupparsi il percorso che porta dalla Qualità Totale alla qualità intesa come "sistema", e all'idea che la stessa filosofia utilizzata per garantire la qualità dei prodotti può essere applicata per garantire la qualità dei servizi. Nei primi anni '70 in Gran Bretagna le principali istituzioni pubblicano i loro standard per assicurare la qualità nella gestione delle commesse (la Ford lo standard Q101, il Ministero della Difesa la serie 05-20): viene introdotto il concetto che la fiducia in un prodotto può essere assicurata mediante un sistema di gestione della qualità e manuali della qualità. Alla fine degli anni '70 in Gran Bretagna viene raggiunto l'accordo su uno standard nazionale per il sistema qualità: la norma B5750, sviluppata dalle precedenti linee guida BS5179 è tuttavia ancora basata su specifiche e terminologia del Ministera della Difesa. In sequenza la normativa passa attraverso le seguenti fasi:→ nel 1979 BSI (British Standards Institution) pubblica la BS5750 "Quality Systems";→ nel 1987 la BS5750, con modifiche non sostanziali, viene adottata dalla ISO (International Organization for Standardization) con il nome di ISO 9000 e dal CEN con il nome di EN 29000→ nel 1994 le norme diventano la serie ISO 9000 (9001, 9002, 9003);→ nel 2000 la UNI EN ISO 9001:2000 combina i tre standard 9001, 9002, and 9003 in un'unica norma;→ nel 2008 la norma del 2000 viene nuovamente rivista e diventa la UNI EN ISO 9001:2008 La ISO 9000 definisce un modello di Sistema Qualità, inteso come strumento di carattere organizzativo/gestionale, focalizzato sul monitoraggio e controllo dei processi che hanno una diretta influenza sulla qualità del servizio erogato, definendo per ogni attività aziendale i criteri da individuare, pianificare e tenere sotto controllo, per la gestione e la valutazione delle proprie attività e delle necessità interne ed esterne. Questo si traduce nella individuazione di adeguate risorse e di un sistema di misurazione basato su indicatori organizzativi, clinici e di processo chiari e misurabili. Con la UNI EN ISO 9001:2000 e con la UNI EN ISO 9001:2008 siamo al Sistema di Gestione per la Qualità. Gli elementi della norma sono inseriti in una visione integrata del processo di produzione del prodotto/servizio, i cui punti focali diventano:→ la responsabilità della direzione;→ la gestione delle risorse materiali, informative, umane e finanziarie;→ la gestione dei processi;→ le misurazioni, l’analisi e il miglioramento continuativo.Le ultime versioni della norma promuovono in questo modo il passaggio dalla certificazione di conformità a quella di efficacia. L’attenzione si sposta dalla verifica dell’applicazione del singolo requisito formale e della sua conformità alla Norma, alla verifica se l’applicazione dei requisiti consente di raggiungere effettivamente gli obiettivi attesi, di migliorarli continuativamente e di darne evidenza oggettiva, utilizzando il cliente come punto di avvio e di arrivo di un ciclo che a fronte di specifiche richieste gli consenta di valutare, alla chiusura del ciclo, la soddisfazione delle sue aspettative. Oggi le norme ISO (International Organization for Standardization, http://www.iso.org/) adottate a livello europeo dal CEN (European Committee for Standardization, l'acronomo deriva dal francese Comité Européen de Normalisation, http://www.cen.eu/) e infine recepite dall'ente di normazione nazionale (in Italia l'UNI, Ente Nazionale di Unificazione) sono norme "armonizzate" e diventano norme UNI EN ISO. Sul sito http://www.uni.com/ trovate cosa è e come nasce una norma, e una serie di link utili. Per un primo approfondimento del metodo Six Sigma rimando all'articolo “Making Sense of Usability Metrics: Usability and Six Sigma” di Sauro e Kindlund, oltre che al sito di J. O. Westgard. ********************************
I principi base o, se volete, le componenti elementari, i denominatori comuni delle tecniche volte ad assicurare la qualità di un prodotto o servizio, sono semplici, quasi ovvi:→ non dare mai niente per scontato;→ scrivere quello che si fa;→ fare quello che è scritto;→ documentare quello che accade.Eppure il cammino per arrivare alla attuale concezione della qualità è stato lungo e complesso. L'evoluzione della cultura della qualità ha attraversato tre fasi storiche: quella del Controllo di Qualità, quella della Assicurazione della Qualità e della Qualità Totale, e quella del Sistema di Gestione per la Qualità. Controllo di Qualità Negli anni '20 del secolo scorso Walter A. Shewhart, che allora lavora per i Bell Laboratories, crea le carte di controllo e il controllo statistico di qualità. Quando un punto cade al di fuori dei limiti stabiliti per una determinata carta i controllo, i responsabili del processo devono verificare se questo può essere stato determinato da una causa specifica, piuttosto che dalle normali deviazioni attese in base alla distribuzione dell'errore. Shewhart stabilisce i limiti 3-sigma (3 volte la deviazione standard) sulla base del fatto che:→ data una qualsiasi distribuzione di probabilità la probabilità di un risultato che si discosta dalla media di oltre k deviazioni standard è inferiore a 1/k2 (diseguaglianza di Chebyshev);→ per una distribuzione gaussiana almeno il 99% delle osservazioni sono contenute all'interno delle 3 deviazioni standard dalla media (intervallo compreso tra media - 2 DS e media + 2 DS). Il metodo "6-sigma" (six-sigma) viene introdotto successivamente, e per la prima volta dalla Motorola, nella seconda metà degli anni 80 da Bob Galvin e Bill Smith, e si diffonde rapidamente nell'industria americana. L'obiettivo della metodologia è di raggiungere un tale controllo del processo da avere soltanto 3,4 parti difettose per milione, il che porta a limiti molto restrittivi sulla variabilità del processo produttivo. La metodologia 6-sigma mira all’eliminazione dei difetti e degli sprechi piuttosto che al semplice miglioramento della prestazione media. Questo garantisce un impatto diretto sul cliente, inteso come fruitore del processo o prodotto. Dal Controllo di Qualità siamo arrivati alla soddisfazione totale del cliente (Total Customer Satisfaction) e quindi alla Assicurazione della qualità. Assicurazione della Qualità e Qualità Totale Il metodo statistico diventa solamente uno strumento all'interno di una filosofia della qualità più generalizzata, tesa ad assicurare la qualità del prodotto, e basata sul ciclo descritto da W. Edwards Deming, che introduce nell'industria giapponese i concetti di gestione che porteranno il Giappone ai vertici della produzione industriale nel mondo. Il ciclo consiste di quattro passi, Plan, Do, Check, Act, noti con l'acronimo PDCA. I quattro passi per assicurare la qualità all'interno del modello consistono rispettivamente in:→ Plan: stabilire gli obiettivi e sviluppare i processi necessari per assicurare i risultati desiderati;→ Do: implementare i processi sviluppati;→ Check: monitorare i processi implementati e valutarli confrontandi il risultati con gli obiettivi prestabiliti;→ Act: applicare le azioni necessarie per migliorare se il risultati evidenziano la necessità di un cambiamento/miglioramento. Contemporaneo di Deming, Joseph M. Juran è un altro dei pionieri nell’ambito della Qualità Totale e, con i suoi settant’anni di carriera, si può considerare a pieno titolo uno dei “padri” della qualità. I tempi sono maturi per il terzo passo, quello della Gestione per la Qualità. Sistema di Gestione per la Qualità L'ultimo quarto del XX secolo vede svilupparsi il percorso che porta dalla Qualità Totale alla qualità intesa come "sistema", e all'idea che la stessa filosofia utilizzata per garantire la qualità dei prodotti può essere applicata per garantire la qualità dei servizi. Nei primi anni '70 in Gran Bretagna le principali istituzioni pubblicano i loro standard per assicurare la qualità nella gestione delle commesse (la Ford lo standard Q101, il Ministero della Difesa la serie 05-20): viene introdotto il concetto che la fiducia in un prodotto può essere assicurata mediante un sistema di gestione della qualità e manuali della qualità. Alla fine degli anni '70 in Gran Bretagna viene raggiunto l'accordo su uno standard nazionale per il sistema qualità: la norma B5750, sviluppata dalle precedenti linee guida BS5179 è tuttavia ancora basata su specifiche e terminologia del Ministera della Difesa. In sequenza la normativa passa attraverso le seguenti fasi:→ nel 1979 BSI (British Standards Institution) pubblica la BS5750 "Quality Systems";→ nel 1987 la BS5750, con modifiche non sostanziali, viene adottata dalla ISO (International Organization for Standardization) con il nome di ISO 9000 e dal CEN con il nome di EN 29000→ nel 1994 le norme diventano la serie ISO 9000 (9001, 9002, 9003);→ nel 2000 la UNI EN ISO 9001:2000 combina i tre standard 9001, 9002, and 9003 in un'unica norma;→ nel 2008 la norma del 2000 viene nuovamente rivista e diventa la UNI EN ISO 9001:2008 La ISO 9000 definisce un modello di Sistema Qualità, inteso come strumento di carattere organizzativo/gestionale, focalizzato sul monitoraggio e controllo dei processi che hanno una diretta influenza sulla qualità del servizio erogato, definendo per ogni attività aziendale i criteri da individuare, pianificare e tenere sotto controllo, per la gestione e la valutazione delle proprie attività e delle necessità interne ed esterne. Questo si traduce nella individuazione di adeguate risorse e di un sistema di misurazione basato su indicatori organizzativi, clinici e di processo chiari e misurabili. Con la UNI EN ISO 9001:2000 e con la UNI EN ISO 9001:2008 siamo al Sistema di Gestione per la Qualità. Gli elementi della norma sono inseriti in una visione integrata del processo di produzione del prodotto/servizio, i cui punti focali diventano:→ la responsabilità della direzione;→ la gestione delle risorse materiali, informative, umane e finanziarie;→ la gestione dei processi;→ le misurazioni, l’analisi e il miglioramento continuativo.Le ultime versioni della norma promuovono in questo modo il passaggio dalla certificazione di conformità a quella di efficacia. L’attenzione si sposta dalla verifica dell’applicazione del singolo requisito formale e della sua conformità alla Norma, alla verifica se l’applicazione dei requisiti consente di raggiungere effettivamente gli obiettivi attesi, di migliorarli continuativamente e di darne evidenza oggettiva, utilizzando il cliente come punto di avvio e di arrivo di un ciclo che a fronte di specifiche richieste gli consenta di valutare, alla chiusura del ciclo, la soddisfazione delle sue aspettative. Oggi le norme ISO (International Organization for Standardization, http://www.iso.org/) adottate a livello europeo dal CEN (European Committee for Standardization, l'acronomo deriva dal francese Comité Européen de Normalisation, http://www.cen.eu/) e infine recepite dall'ente di normazione nazionale (in Italia l'UNI, Ente Nazionale di Unificazione) sono norme "armonizzate" e diventano norme UNI EN ISO. Sul sito http://www.uni.com/ trovate cosa è e come nasce una norma, e una serie di link utili. Per un primo approfondimento del metodo Six Sigma rimando all'articolo “Making Sense of Usability Metrics: Usability and Six Sigma” di Sauro e Kindlund, oltre che al sito di J. O. Westgard. ********************************
 Certificazione La certificazione è una procedura con la quale una parte terza dà assicurazione scritta che un sistema di gestione o un prodotto è conforme ai requisiti specificati in una norma. L’organismo di Certificazione e Ispezione che rilascia una certificazione di un sistema di gestione opera in accordo ai requisiti della norma UNI CEI EN ISO/IEC 17021:2006 “Valutazione della conformità - Requisiti per gli organismi che forniscono audit e certificazione di sistemi di gestione”. Esempi di sistemi di gestione certificabili sono:→ il sistema di gestione aziendale per la qualità, che può essere certificato secondo la norma UNI EN ISO 9001:2008;→ il sistema di gestione aziendale per la salute e sicurezza sui luoghi di lavoro, che può essere certificato secondo la norma OHSAS 18001:2007 (dove OHSAS è l’acronimo di Occupational Health and Safety Assessment Series);→ il sistema di gestione aziendale per l’ambiente, che può essere certificato secondo la norma UNI EN ISO 14001:2004;→ il sistema di gestione per la sicurezza alimentare, che può essere certificato secondo la norma ISO 22000:2005. L’organismo di Certificazione e Ispezione che rilascia una certificazione di prodotto opera in accordo ai requisiti della norma UNI CEI EN 45011:1999 “Requisiti generali relativi agli organismi che gestiscono sistemi di certificazione di prodotti”. Vi sono due tipi di certificazione di prodotto:→ la certificazione volontaria, che ha l’obiettivo di rendere riconoscibili sul mercato le caratteristiche dei prodotti fornendo riferimenti precisi e identificabili al consumatore, e quindi rappresenta un efficace strumento di promozione sul mercato;→ la certificazione obbligatoria, come ad esempio quella prevista dal DL 8 settembre 2002, n. 332 “Attuazione della direttiva 98/79/CE relativa ai dispositivi medico-diagnostici in vitro”, pubblicata sulla Gazzetta Ufficiale n. 269 del 17 novembre 2000, S.O. n. 189, che prevede il rispetto di requisiti specifici e quindi la marchiatura CE per i prodotti diagnostici del laboratorio di analisi cliniche. La certificazione obbligatoria ha lo scopo di (i) garantire i requisiti essenziali del prodotto a tutela della salute e della sicurezza delle persone durante il suo utilizzo, (ii) tutelare i produttori europei dalla concorrenza sleale da parte di produttori di altre aree geografiche che non si adeguano alle prescrizioni applicabili al prodotto specifico, e (iii) consentire la libera circolazione del prodotto nella dimensione comunitaria superando così le barriere di tipo tecnico e normativo dei diversi paesi della Unione Europea (UE). Accreditamento L’accreditamento è la procedura con la quale un organismo autorevole conferisce il riconoscimento formale che un organismo o una persona è competente ad eseguire specifici compiti. L’organismo (di parte terza) che rilascia un accreditamento opera in accordo ai requisiti della norma UNI CEI EN ISO/IEC 17011:2005 “Valutazione della conformità - Requisiti generali per gli organismi di accreditamento che accreditano organismi di valutazione della conformità” Nell’ambito dell’accreditamento sono previsti:→ l’accreditamento degli organismi di certificazione e ispezione, che a loro volta svolgono attività di certificazione di sistema e di certificazione di prodotto (vedi sopra);→ l'accreditamento dei laboratori di prova che risultano conformi ai requisiti della UNI CEI EN ISO/IEC 17025:2005 "Requisiti generali per la competenza dei laboratori di prova e taratura.". L’accreditamento dimostra la competenza tecnica del laboratorio ad effettuare le prove dallo stesso indicate, e conferma l’attuazione di un sistema gestionale per la qualità allineato ai principi della ISO 9001:2008. Per le prove indicate viene verificata la conformità ai requisiti tecnici previsti;→ l’accreditamento dei laboratori di taratura, sui quali si appoggia il sistema metrologico nazionale. Una nota aggiuntiva per la norma ISO 15189:2007 “Medical laboratories - Particular requirements for quality and competence”, che recita testualmente “This International Standard is not intended to be used for the purposes of certification” e ancora recita “This second edition cancels and replaces the first edition (ISO 15189:2003) which has been technically revised in order to align it more closely with the second edition of ISO/IEC 17025”. Tre fatti, cioè che la ISO 15189 non è certificabile, che la nuova versione è stata allineata alla ISO/IEC 17025, e gli stessi titoli delle due norme (ISO/IEC 17025 “Requisiti generali per la competenza dei laboratori...” e ISO 15189 “Laboratori medici - Requisiti particolari ... per la competenza”) indicano in modo evidente che la ISO 15189 appartiene al mondo dell’accreditamento, ed è strettamente collegata alla ISO/IEC 17025. Di fatto per un laboratorio di analisi cliniche adottare la ISO 15189 significa rientrare della stessa logica di accreditamento dei laboratori di prova, e accreditare la propria competenza nell’esecuzione delle singole specifiche prove (analisi di laboratorio). Quale sia il valore aggiunto dell’accreditamento ISO 15189 rispetto alla certificazione ISO 9001 nei casi in cui le prove (analisi di laboratorio) sono già normate dalla direttiva sulla diagnostica in vitro con marchiatura CE dei diagnostici è argomento di discussione. Sicuramente ci può essere un valore aggiunto nelle aree nelle quali il laboratorio voglia o debba mettere a punto test specifici (un esempio tipico è il cariotipo, per il quale non esistono diagnostici e nel quale i preparati cromosomici devono essere realizzati per intero manualmente rispettando condizioni operative rigorosissime). Regolamentazione governativa delle attività sanitarie Il quadro sopra descritto sarebbe tutto sommato abbastanza logico e lineare se non si aggiungessero le esigenze di regolamentazione delle attività sanitarie da o per conto del Governo: oggi, sostanzialmente, sono le Regioni a farlo. Queste istituzioni, oltre ad esercitare attività di controllo, richiedono ai soggetti che intendono esercitare attività sanitarie dei requisiti obbligatori, che portano all’autorizzazione e all’accreditamento. Possono essere distinti in questo senso diversi livelli, che possono differire nelle varie Regioni:→ l’autorizzazione della struttura, necessaria per realizzare una struttura sanitaria;→ l’autorizzazione dell’attività, necessaria per lo svolgimento di una attività sanitaria;→ l’accreditamento istituzionale, che consente di erogare prestazioni di ricovero e ambulatoriali in regime privatistico (l’attributo “istituzionale” è necessario per evitare i problemi di ambiguità derivanti dall’utilizzo dell’espressione “accreditamento” in differenti contesti);→ la messa a contratto, che consente di erogare, sulla base di uno specifico contratto con la Regione, che prevede tetti di spesa predefiniti e non superabili, prestazioni di ricovero e ambulatoriali riconosciute e rimborsate dal Servizio Sanitario Nazionale. Per un esempio pratico di norme che regolano l’autorizzazione e l’accreditamento in Sanità, si rimanda al sito della Regione Lombardia, Direzione Generale Sanità, all’indirizzo http://www.sanita.regione.lombardia.it/ alla voce Qualità e Controllo. Mondo sanitario e accreditamento A complicare ulteriormente la nozione di accreditamento vi sono altri tipi di accreditamento, tutti tesi a documentare che un organismo o una persona è competente ad eseguire specifici compiti, e basati sulla triade:→ accreditamento all’eccellenza;→ accreditamento di tipo volontario;→ accreditamento promosso dall’interno del mondo sanitario.Fanno parte di questo tipo di accreditamento, tra gli altri:→ il modello di accreditamento JCAHO (Joint Commission on Accreditation of Healthcare Organizations, http://www.jointcommission.org/), il sistema di accreditamento statunitense. Si fa notare che attualmente la Regione Lombardia sta sperimentando un processo di implementazione graduale dei requisiti JCAHO presso alcuni dei suoi Ospedali;→ il modello di accreditamento CPA (Clinical Patology Accreditation, http://www.cpa-uk.co.uk/) che prende spunto dal precedente e accredita i servizi di patologia clinica nel Regno Unito;→ l’accreditamento professionale, proposto in Italia da varie Società Scientifiche. Ha un carattere fortemente partecipativo, si propone come una attività di autoregolamentazione, e prevede un meccanismo di valutazione esterna tra pari (peer review) teso ad accertare il grado di corrispondenza a una serie di indicatori di qualità ampiamente condivisi. Il problema cruciale per l’accreditamento professionale, il problema che oncor oggi ne limita l’operatività e l’applicabilità, è rappresentato dalla capacità di fornire una garanzia di assoluta neutralità e indipendenza nel giudizio:→ chi può effettuare la valutazione (della competenza di un laboratorio)? → come si assicura la assenza di conflitti di interesse (nella valutazione della competenza di un laboratorio)?→ come si può garantire che un ispettore che è dipendente di un laboratorio pubblico sia oggettivo nelle conclusioni della sua ispezione ad un laboratorio privato?→ come si può garantire che un ispettore che è dipendente di un laboratorio privato sia oggettivo nelle conclusioni della sua ispezione ad un laboratorio pubblico?→ come si può garantire che un ispettore che è collega ed amico di un altro lavoratore che opera in un laboratorio pubblico sia oggettivo nelle conclusioni della sua ispezione all’amico e collega?→ come si può garantire che un ispettore che è collega ed amico di un altro lavoratore che opera in un laboratorio privato sia oggettivo nelle conclusioni della sua ispezione all’amico e collega? Delle implicazioni di questi tipi di approccio discuterò successivamente. Cerco ora di riassumere il tutto in un quadro sinottico, nel quale nell’ultima colonna sulla destra la sigla “na” indica che si tratta di requisito non applicabile ai laboratori di analisi cliniche/mediche, mentre la sigla “A” indica che si tratta di un requisito Applicabile ai laboratori di analisi cliniche/mediche.
Certificazione La certificazione è una procedura con la quale una parte terza dà assicurazione scritta che un sistema di gestione o un prodotto è conforme ai requisiti specificati in una norma. L’organismo di Certificazione e Ispezione che rilascia una certificazione di un sistema di gestione opera in accordo ai requisiti della norma UNI CEI EN ISO/IEC 17021:2006 “Valutazione della conformità - Requisiti per gli organismi che forniscono audit e certificazione di sistemi di gestione”. Esempi di sistemi di gestione certificabili sono:→ il sistema di gestione aziendale per la qualità, che può essere certificato secondo la norma UNI EN ISO 9001:2008;→ il sistema di gestione aziendale per la salute e sicurezza sui luoghi di lavoro, che può essere certificato secondo la norma OHSAS 18001:2007 (dove OHSAS è l’acronimo di Occupational Health and Safety Assessment Series);→ il sistema di gestione aziendale per l’ambiente, che può essere certificato secondo la norma UNI EN ISO 14001:2004;→ il sistema di gestione per la sicurezza alimentare, che può essere certificato secondo la norma ISO 22000:2005. L’organismo di Certificazione e Ispezione che rilascia una certificazione di prodotto opera in accordo ai requisiti della norma UNI CEI EN 45011:1999 “Requisiti generali relativi agli organismi che gestiscono sistemi di certificazione di prodotti”. Vi sono due tipi di certificazione di prodotto:→ la certificazione volontaria, che ha l’obiettivo di rendere riconoscibili sul mercato le caratteristiche dei prodotti fornendo riferimenti precisi e identificabili al consumatore, e quindi rappresenta un efficace strumento di promozione sul mercato;→ la certificazione obbligatoria, come ad esempio quella prevista dal DL 8 settembre 2002, n. 332 “Attuazione della direttiva 98/79/CE relativa ai dispositivi medico-diagnostici in vitro”, pubblicata sulla Gazzetta Ufficiale n. 269 del 17 novembre 2000, S.O. n. 189, che prevede il rispetto di requisiti specifici e quindi la marchiatura CE per i prodotti diagnostici del laboratorio di analisi cliniche. La certificazione obbligatoria ha lo scopo di (i) garantire i requisiti essenziali del prodotto a tutela della salute e della sicurezza delle persone durante il suo utilizzo, (ii) tutelare i produttori europei dalla concorrenza sleale da parte di produttori di altre aree geografiche che non si adeguano alle prescrizioni applicabili al prodotto specifico, e (iii) consentire la libera circolazione del prodotto nella dimensione comunitaria superando così le barriere di tipo tecnico e normativo dei diversi paesi della Unione Europea (UE). Accreditamento L’accreditamento è la procedura con la quale un organismo autorevole conferisce il riconoscimento formale che un organismo o una persona è competente ad eseguire specifici compiti. L’organismo (di parte terza) che rilascia un accreditamento opera in accordo ai requisiti della norma UNI CEI EN ISO/IEC 17011:2005 “Valutazione della conformità - Requisiti generali per gli organismi di accreditamento che accreditano organismi di valutazione della conformità” Nell’ambito dell’accreditamento sono previsti:→ l’accreditamento degli organismi di certificazione e ispezione, che a loro volta svolgono attività di certificazione di sistema e di certificazione di prodotto (vedi sopra);→ l'accreditamento dei laboratori di prova che risultano conformi ai requisiti della UNI CEI EN ISO/IEC 17025:2005 "Requisiti generali per la competenza dei laboratori di prova e taratura.". L’accreditamento dimostra la competenza tecnica del laboratorio ad effettuare le prove dallo stesso indicate, e conferma l’attuazione di un sistema gestionale per la qualità allineato ai principi della ISO 9001:2008. Per le prove indicate viene verificata la conformità ai requisiti tecnici previsti;→ l’accreditamento dei laboratori di taratura, sui quali si appoggia il sistema metrologico nazionale. Una nota aggiuntiva per la norma ISO 15189:2007 “Medical laboratories - Particular requirements for quality and competence”, che recita testualmente “This International Standard is not intended to be used for the purposes of certification” e ancora recita “This second edition cancels and replaces the first edition (ISO 15189:2003) which has been technically revised in order to align it more closely with the second edition of ISO/IEC 17025”. Tre fatti, cioè che la ISO 15189 non è certificabile, che la nuova versione è stata allineata alla ISO/IEC 17025, e gli stessi titoli delle due norme (ISO/IEC 17025 “Requisiti generali per la competenza dei laboratori...” e ISO 15189 “Laboratori medici - Requisiti particolari ... per la competenza”) indicano in modo evidente che la ISO 15189 appartiene al mondo dell’accreditamento, ed è strettamente collegata alla ISO/IEC 17025. Di fatto per un laboratorio di analisi cliniche adottare la ISO 15189 significa rientrare della stessa logica di accreditamento dei laboratori di prova, e accreditare la propria competenza nell’esecuzione delle singole specifiche prove (analisi di laboratorio). Quale sia il valore aggiunto dell’accreditamento ISO 15189 rispetto alla certificazione ISO 9001 nei casi in cui le prove (analisi di laboratorio) sono già normate dalla direttiva sulla diagnostica in vitro con marchiatura CE dei diagnostici è argomento di discussione. Sicuramente ci può essere un valore aggiunto nelle aree nelle quali il laboratorio voglia o debba mettere a punto test specifici (un esempio tipico è il cariotipo, per il quale non esistono diagnostici e nel quale i preparati cromosomici devono essere realizzati per intero manualmente rispettando condizioni operative rigorosissime). Regolamentazione governativa delle attività sanitarie Il quadro sopra descritto sarebbe tutto sommato abbastanza logico e lineare se non si aggiungessero le esigenze di regolamentazione delle attività sanitarie da o per conto del Governo: oggi, sostanzialmente, sono le Regioni a farlo. Queste istituzioni, oltre ad esercitare attività di controllo, richiedono ai soggetti che intendono esercitare attività sanitarie dei requisiti obbligatori, che portano all’autorizzazione e all’accreditamento. Possono essere distinti in questo senso diversi livelli, che possono differire nelle varie Regioni:→ l’autorizzazione della struttura, necessaria per realizzare una struttura sanitaria;→ l’autorizzazione dell’attività, necessaria per lo svolgimento di una attività sanitaria;→ l’accreditamento istituzionale, che consente di erogare prestazioni di ricovero e ambulatoriali in regime privatistico (l’attributo “istituzionale” è necessario per evitare i problemi di ambiguità derivanti dall’utilizzo dell’espressione “accreditamento” in differenti contesti);→ la messa a contratto, che consente di erogare, sulla base di uno specifico contratto con la Regione, che prevede tetti di spesa predefiniti e non superabili, prestazioni di ricovero e ambulatoriali riconosciute e rimborsate dal Servizio Sanitario Nazionale. Per un esempio pratico di norme che regolano l’autorizzazione e l’accreditamento in Sanità, si rimanda al sito della Regione Lombardia, Direzione Generale Sanità, all’indirizzo http://www.sanita.regione.lombardia.it/ alla voce Qualità e Controllo. Mondo sanitario e accreditamento A complicare ulteriormente la nozione di accreditamento vi sono altri tipi di accreditamento, tutti tesi a documentare che un organismo o una persona è competente ad eseguire specifici compiti, e basati sulla triade:→ accreditamento all’eccellenza;→ accreditamento di tipo volontario;→ accreditamento promosso dall’interno del mondo sanitario.Fanno parte di questo tipo di accreditamento, tra gli altri:→ il modello di accreditamento JCAHO (Joint Commission on Accreditation of Healthcare Organizations, http://www.jointcommission.org/), il sistema di accreditamento statunitense. Si fa notare che attualmente la Regione Lombardia sta sperimentando un processo di implementazione graduale dei requisiti JCAHO presso alcuni dei suoi Ospedali;→ il modello di accreditamento CPA (Clinical Patology Accreditation, http://www.cpa-uk.co.uk/) che prende spunto dal precedente e accredita i servizi di patologia clinica nel Regno Unito;→ l’accreditamento professionale, proposto in Italia da varie Società Scientifiche. Ha un carattere fortemente partecipativo, si propone come una attività di autoregolamentazione, e prevede un meccanismo di valutazione esterna tra pari (peer review) teso ad accertare il grado di corrispondenza a una serie di indicatori di qualità ampiamente condivisi. Il problema cruciale per l’accreditamento professionale, il problema che oncor oggi ne limita l’operatività e l’applicabilità, è rappresentato dalla capacità di fornire una garanzia di assoluta neutralità e indipendenza nel giudizio:→ chi può effettuare la valutazione (della competenza di un laboratorio)? → come si assicura la assenza di conflitti di interesse (nella valutazione della competenza di un laboratorio)?→ come si può garantire che un ispettore che è dipendente di un laboratorio pubblico sia oggettivo nelle conclusioni della sua ispezione ad un laboratorio privato?→ come si può garantire che un ispettore che è dipendente di un laboratorio privato sia oggettivo nelle conclusioni della sua ispezione ad un laboratorio pubblico?→ come si può garantire che un ispettore che è collega ed amico di un altro lavoratore che opera in un laboratorio pubblico sia oggettivo nelle conclusioni della sua ispezione all’amico e collega?→ come si può garantire che un ispettore che è collega ed amico di un altro lavoratore che opera in un laboratorio privato sia oggettivo nelle conclusioni della sua ispezione all’amico e collega? Delle implicazioni di questi tipi di approccio discuterò successivamente. Cerco ora di riassumere il tutto in un quadro sinottico, nel quale nell’ultima colonna sulla destra la sigla “na” indica che si tratta di requisito non applicabile ai laboratori di analisi cliniche/mediche, mentre la sigla “A” indica che si tratta di un requisito Applicabile ai laboratori di analisi cliniche/mediche.
| OrganismoRequisitoTipologia | |||
| ACCREDIAAccreditamentoObbligatorio | |||
| ACCREDIAAccreditamentoVolontario | |||
| ACCREDIAAccreditamentoObbligatorio | |||
| Organismo di CertificazioneCertificazione di sistemaVolontaria | |||
| Organismo di CertificazioneCertificazione di prodottoObbligatoria | |||
| RegioneAutorizzazione della strutturaObbligatoria | |||
| RegioneAutorizzazione della attivitàObbligatoria | |||
| RegioneAccreditamento istituzionaleObbligatorio | |||
| Società ScientificaAccreditamento professionaleVolontario |
|
|
|
|
|
|
|
|
Ultimo aggiornamento: 20 febbraio 2023
NOTA SUI COLLEGAMENTIALLE FONTI BIBLIOGRAFICHE La maggior parte dei collegamenti ad articoli scientifici riportati nel sito fa riferimento a riviste online che forniscono gratuitamente l’articolo originale. In alcuni casi è necessario registrarsi sul sito per avere libero accesso agli articoli: questo accade per esempio con il BMJ. Quando i collegamenti fanno riferimento a fonti bibliografiche a pagamento, chi non ha sottoscritto un abbonamento con la rivista potrebbe vedere comparire un messaggio del tipo “access forbidden”, ma il più delle volte vedrà comparire una pagina che consente di acquistare online l’articolo originale.
Programma di statistica Ministat (versione per Windows)

Programma di statistica Open Source R(per Linux, Mac OS X e Windows)
Manuale Merck di diagnosie terapia
L’articolo da non perdere...
Errori congeniti del metabolismo
I migliori libri del mese Leonard Mlodinow La passeggiata dell’ubriaco. Le leggi scientifiche del caso.Rizzoli Editore, 2009, pp. 294ISBN: 17034081
OpenOffice, la suite Open Source (per Linux, Mac OS X e Windows)
ebooks... Mauss, Berg, Rockstroh, Sarrazin, Wedemeyer.Hepatology - A clinical textbook. 10th Edition - 2020
Le lettureconsigliate
Atlante di anatomia del Bock
Tavole metaboliche
Informazioni: info@bayes.itScrivimi: webmaster@bayes.it
NOTA LEGALE L’interpretazione dei risultati delle analisi di laboratorio deve essere effettuata esclusivamente dal medico e alla luce dei dati clinici.Questo sito ha uno scopo esclusivamente educativo e formativo. Pertanto le informazioni in esso contenute possono essere utilizzate esclusivamente a scopo didattico, e anche in questo caso sotto la responsabilità personale di chi le utilizza, sia per sé stesso sia per terzi.Le informazioni contenute in questo sito non possono e non devono essere utilizzate né a scopo diagnostico, né a scopo prognostico, né a scopo terapeutico, né per qualsiasi attività che abbia un impatto sia diretto sia indiretto sullo stato di salute di un individuo o di più individui.Nessuna responsabilità può essere imputata all’autore per danni diretti o indiretti e di qualsivoglia natura che potrebbero essere causati a sé stessi o a terzi a causa di errori, imprecisioni, omissioni, interpretazioni o utilizzo dei contenuti di questo sito o dei siti cui esso fa riferimento.
E ora che i test genetici sono alla portata di tutti?Con meno di mille euro è possibile comprare un test genetico su Internet: si manda un piccolo campione di cellule e poi si aspetta la risposta. Ma... a che cosa serve la risposta? Un dossier di Marika De Acetis dall’Archivio storico del sito www.torinoscienza.it
[Home] [Errori cognitivi] [Epistemologia] [Teorema di Bayes] [Decisioni mediche] [Le basi biochimiche][Analisi tradizionali] [Analisi genetiche] [Qualità in laboratorio] [Statistica e laboratorio][Storia delle medicina] [Download] [Link] [Bacheca] [FAQ] [Chi sono]
Attualità in tema di eGFR:
I migliori libri del mese Giovanni Federspil Logica clinica. I principi del metodo in medicina.McGraw-Hill, 2004, pp. 368ISBN: 88 386 2984-6
Atlante di virologia
Dal settembre 2008oltre 400 000 visitatori
ebooks... M. BesozziErrori cognitivi, probabilità e decisioni mediche. Fate click sul titolo o scaricate il testo su tablet o smartphone con il codice a barre riportato qui sotto. 

Atlante dei protozoi intestinali
Atlante di citologia e istologia
Statistica e grafica con R
Espressione dei risultati nel laboratorio di chimica clinica
Pathology outlines
Atlante di anatomia del Gray
Atlante di ematologia
Atlante di parassitologia
Micobatteriologia clinica
Concetti, metodi e strumenti per una
buona informazione
ebooks... M. BesozziStatistica e grafica con R Fate click sul titolo o scaricate il testo su tablet o smartphone con il codice a barre riportato qui sotto. 

I migliori libri del mese Luigi Tesio I bravi e i buoni.Perché la medicina clinica può essere una scienza.Il Pensiero Scientifico Editore, 2015, pp. 216 ISBN: 978-88-490-0538-7
Gli inganni della correlazione:
Storia delle unità di misura
Questo sito è stato archiviato ed è reso disponibile esclusivamente come memoria storica: pertanto è escluso ogni suo possibile utilizzo medico. Le parti del sito riservate al teorema di Bayes rimangono concettualmente valide, ma declino qualsiasi responsabilità per la lenta ma inevitabile obsolescenza dei restanti contenuti dovuta alla comparsa di nuove analisi di laboratorio, di progressi nelle analisi genetiche, di link interrotti, e quant’altro.
.